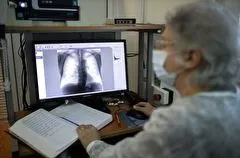
Interfax-Russia.ru – Искусственный интеллект научили распознавать несколько видов опухоли мозга на МРТ-изображениях. В будущем программу планируют научить диагностировать очаги рассеянного склероза.
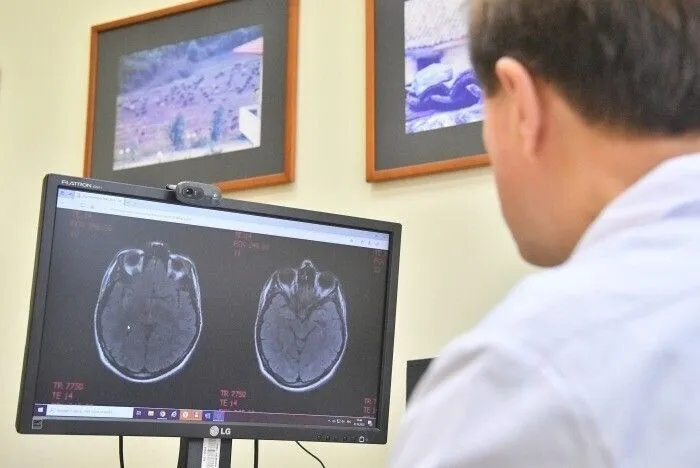
Исследователи Новосибирского государственного университета (НГУ) совместно с коллегами из Федерального центра нейрохирургии (ФЦН) разработали программный модуль для дифференциальной диагностики новообразований головного мозга на МРТ-изображениях и при хирургических операциях.
"В основе разработки лежат двух- и трехмерные модели компьютерного зрения с предварительной обработкой данных нескольких снимков МРТ мозга — с введением контрастного вещества в кровь пациента и без него. Эти модели позволяют с высокой точностью распознать четыре типа опухолей: менингиому, невриному, глиобластому и астроцитому, а также определить их компоненты и размеры", — сообщил заведующий лабораторией аналитики потоковых данных и машинного обучения Механико-математического факультета НГУ Евгений Павловский.
Всего, как отмечают в вузе, в программный модуль "подгрузили" данные более тысячи пациентов с такими диагнозами, которые в дальнейшем использовали для обучения алгоритмов искусственного интеллекта (ИИ).
"Они пока, конечно, не обладают свойством объяснимости, но наша следующая работа будет посвящена именно этой проблеме: планируем научить алгоритм объяснять, почему он выдал именно такой контур опухоли и именно так ее классифицировал. Сделать это будет непросто, но уже существующий алгоритм имеет у экспертов высокую степень подтверждаемости и выдает информацию высокой степени объективности", — отметил Павловский.
Так, по информации университета, сначала ученые проверили точность алгоритма на собственной базе данных, а затем на тестовом наборе данных по метрике Дайса, определяющей меру сходства объектов.
"По классификации полученные результаты демонстрируют не только высокие показатели точности — до 92% при анализе пациентов, но и очень высокий потенциал, а также перспективу для будущих исследований в этой области", — пояснил заведующий лабораторией аналитики потоковых данных и машинного обучения НГУ.
Также, по его словам, разработанный программный модуль можно использовать для обучения специалистов.
"О его внедрении в клиническую практику пока говорить рано, потому что он пока не прошел необходимых для этого испытаний", — отметил эксперт.
Помимо этого, как рассказали в пресс-службе вуза, специалисты планируют научить ИИ диагностировать очаги рассеянного склероза. Сделать это сложнее, поскольку по размеру они гораздо меньше опухоли, и только обведением контуров здесь не обойтись.
"Кроме того, если опухоль медленно растет на одном месте, то очаги рассеянного склероза появляются и исчезают. Искусственному интеллекту нужно будет не только их зафиксировать в определенный момент, но и отследить, куда они переместились или как объединились между собой", — пояснили в НГУ.
В свою очередь специалисты Института автоматики и электрометрии СО РАН (ИАиЭ) разработали методику выявления глиальной опухоли головного мозга с помощью терагерцовой спектроскопии жидкостей организма.
"Метод сибирских ученых заключается в анализе спектров терагерцового диапазона частот и технологии машинного обучения или искусственного интеллекта. Такой способ диагностики позволяет обнаружить онкологическое заболевание еще до появления первых симптомов", — сообщает издание СО РАН "Наука в Сибири".
Эффективность новой методики специалисты проверили на лабораторных мышах. Животным подсадили раковые клетки, а затем мониторили их кровь, чтобы фиксировать изменения спектрального отклика в терагерцовом диапазоне частот.
В итоге ученые смогли определить наиболее характерные частоты для корреляции между размером глиомы и спектральным откликом, а также выделили достоверные частоты на разных этапах эксперимента. В конечном счете они выявили разницу в спектрах плазмы крови здоровых людей, пациентов с глиомой и пациентов, имеющих травмы черепа.
Сейчас, как отмечается в публикации, на основе этих данных ученые ИАиЭ ведут разработку терагерцовых наносенсоров.
"Попадание молекулы онкомаркера (например, из капли плазмы крови пациента) на такую структуру изменяет характеристики резонанса, которые мы наблюдаем с помощью разработанного нами спектрометра", — сообщил руководитель лаборатории терагерцовой фотоники ИАиЭ Назар Николаев.
По мнению исследователей, метод терагерцовой спектроскопии на дооперационной диагностике позволит намного раньше выявлять болезнь, также он может использоваться в рамках скринингового обследования при диспансеризации.
Спектр частот терагерцового излучения расположен между инфракрасным и сверхвысокочастотным диапазонами, проникает через многие материалы, кроме металлов. В отличие от рентгеновского излучения, не является ионизирующим.
Тем временем, красноярские ученые разработали способ разрушения раковых клеток с помощью металлических наночастиц и слабого переменного магнитного поля.
"Оказалось, что взаимодействие между наночастицами происходит таким образом, что наночастички выстраиваются вокруг клетки, образуя лучики вокруг нее, действуют сообща и, что интересно, в слабом переменном магнитном поле они могут вызывать разрыв этой клетки", — сообщила ведущий научный сотрудник Красноярского научного центра (КНЦ) СО РАН, руководитель лаборатории биомолекулярных и медицинских технологий КрасГМУ им. В.Ф. Войно-Ясенецкого Анна Кичкайло.
Так, по ее словам, ученые с помощью индустриального партнера изготовили нанодиски, имеющие в составе золото и никель, которые затем модифицировали аптамерами (одноцепочечными последовательностями ДНК или РНК).
"Благодаря своей структуре они способны с высокой специфичностью связываться с нужными клетками, прикрепляясь к их мембранам", — пояснила эксперт.
Глава лаборатории рассказала, что пока для активации препарата используют устройство наподобие магнитно-резонансного томографа (МРТ), но со слабым магнитным полем.
"Проведены опыты на мышах, у которых были инициированы опухоли. В итоге без лечения опухоль давала метастазы и животные погибали через 20 дней, то есть, сравнительно быстро. Животные, которым делали химиотерапию, жили ненамного дольше, у них также наблюдались метастазы, сказала Кичкайло. При этом мыши, которым провели терапию с помощью наночастиц и магнитов, прожили от 50 до 100 дней", — рассказала она.
Также, по словам эксперта, аптамеры можно использовать для блокирования рецептор-связывающих доменов, чтобы предотвратить попадание патогена в клетку, доставки радиофармпрепаратов в клетку — такую работу красноярские ученые ведут совместно с ФМБА, а также для диагностики.
"Сделали опухоль-специфический аптамер для визуализации и терапии глиомы головного мозга: один — для диагностики, другой — для терапии", — сказала Кичкайло.
Ранее красноярские ученые совместно с канадскими коллегами разработали способ адресного разрушения раковых клеток с помощью модифицированных аптамерами наночастиц золота и теплового воздействия, вызванного лазерным излучением.